
Selon un nouveau rapport de la Fédération mondiale de l’obésité publié à la veille de la Journée Mondiale de l’obésité (4 mars), plus de la moitié de la population mondiale sera obèse ou en surpoids d’ici 2035.
L’organisation estime que 51% de la population mondiale vivra en surpoids ou sera obèse d’ici douze ans si “la prévention et les traitements ne s’améliorent pas”.
Sans une approche préventive et un soutien holistique, une personne sur quatre pourrait potentiellement souffrir d’obésité, contre une sur sept aujourd’hui.
Les chiffres sont interpellant : 764 millions de personnes dans le monde sont actuellement obèses et ce nombre devrait atteindre 1 milliard en 2030*. En Belgique, la situation est également critique, 50% des adultes sont en surpoids et 20% des adultes souffrent d’obésité.
L’approche isolée « il suffit de manger moins et bouger plus » n’est pas efficace et désigner la génétique comme unique coupable est devenu obsolète.
Parcourons concrètement les approches adoptées sur base des dernières recherches scientifiques.
Les 12 causes principales de la prise de poids
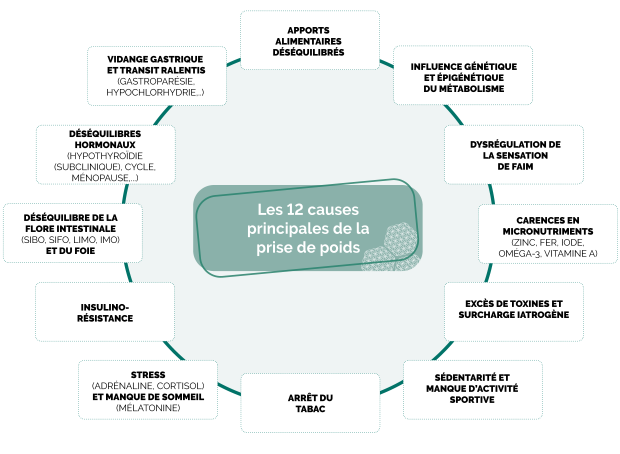
Zoom sur 3 causes
1. Déséquilibre de la flore intestinale (SIBO, SIFO, LIBO, IMO)

Dysbiose et surpoids : quelles sont les dernières avancées ?
Selon les dernières recherches, les personnes en surpoids et obèses ont une flore intestinale appauvrie et moins diversifiée au niveau du gros intestin (LIBO) en association ou non avec une prolifération bactérienne dans l’intestin grêle (SIBO). (1)
De plus, la diversité globale du microbiote intestinal est inversement proportionnelle à l’indice de masse corporelle (IMC), le pourcentage de graisse corporelle, l’insuline, la leptine, les concentrations en protéine C-réactive et l’évaluation du modèle d’homéostasie de résistance à l’insuline (HOMA-IR). (2)
En cas de LIBO, la supplémentation en probiotiques et même prébiotiques favorise la perte de poids en optimalisant la production d’acides gras à courtes chaînes. (3)
Au niveau de l’intestin grêle, la présence de SIBO est également directement corrélée à un pourcentage de graisse corporelle, IMC plus élevé ainsi qu’au diabète de type I et II.
Le SIBO le plus fréquent implique un excès de Firmicutes (Fusobacteria, Proteobacteria,..) par rapport au Bacteroidetes (Akkermansia m., Faecalibacterium p., L Plantarum, L. casei,..).
Il existe trois types de SIBO : dominance d’hydrogène (SIBO H), de méthane (IMO CH4) ou de disulfide d’hydrogène (SIBO H2S).
Le SIBO peut favoriser un excès de calories ainsi qu’une hyper perméabilité intestinale LPS plus élevée. Cela peut alors provoquer un excès d’acides gras à courtes chaînes dans l’intestin grêle, une inflammation de bas grade, une hyperplasie adipocytaire ainsi qu’une diminution de la sensibilité à l’insuline, favorisant la présence de graisse abdominale. (4)
Concernant l’IMO, ou prolifération méthanogène dans l’intestin grêle et/ou gros intestin, des études récentes ont découvert qu’une partie (~5%) des personnes obèses présentaient des taux de méthane plus élevés lors des tests respiratoires. La production de méthane ralentit le transit intestinal en faveur de la constipation modérée à sévère. (5)
Le SIFO, ou prolifération fongique dans l’intestin grêle, est également de plus en plus présent suite à la prise d’antibiotiques et à une alimentation déséquilibrée.
Il peut être présent seul ou en association avec le SIBO/IMO/LIBO. (6)
Il n’y a pas d’étude claire ayant analysé le lien entre surpoids et SIFO mais on peut supposer que l’excès de candida albicans génère des envies de sucre importantes, amenant un excès de calories.
La perte de poids et le soutien hépatique
La perte de poids rapide peut entraîner un relargage de toxines stockées dans les tissus adipeux. Lorsque les cellules adipeuses sont décomposées pour fournir de l’énergie pendant une perte de poids rapide, les toxines qui y sont stockées peuvent être libérées dans la circulation sanguine.
Une perte de poids rapide peut entraîner une surcharge hépatique et compromettre sa fonction, ce qui va provoquer divers effets secondaires et symptômes.
Il est essentiel de soutenir son foie lors d’une perte de poids afin de maintenir la santé métabolique, favoriser la détoxification et prévenir les complications hépatiques potentielles.
Quels acides gras polyinsaturés proposer ?
Plusieurs analyses ont mis en évidence l’inégalité des graisses entre elles pour leurs conséquences sur le bilan énergétique et sur la lipolyse. En effet, lorsque les acides gras essentiels saturés sont remplacés par des huiles de poissons, le rendement énergétique est amélioré.
A la lumière de ces analyses, il semble important de ne pas restreindre les apports lipidiques de manière excessive et, en particulier, de privilégier les apports en acides gras oméga-3. (7)

2. Insulino-résistance et surpoids
L’insulino-résistance (IR) est définie comme l’incapacité du corps à traiter une élévation de la glycémie et métabolisation du glucose à la suite de l’élévation de l’insuline. L’insulino-résistance va de pair avec la formation de foie gras ou NASH dans 98% des cas. (8)
La présence d’IR et de NASH concerne cependant autant les personnes minces que celles en surpoids. 65% des personnes abdominalement obèses démontrent une IR/NASH (IMC>25) (BMJ Journal. (9)), dont 20-30% auraient un SIBO (résultats d’études à confirmer). (10)
Dans tous les cas, 50% des personnes souffrant d’IR/NASH, indépendamment du poids, auraient un SIBO. (11)
Sans une optimalisation de l’assiette et soutien phyto- et nutrithérapeutique, les patients insulino-résistants ont beaucoup de mal à perdre du poids.
Le Reducose®, le resvératrol, le chrome, le gymnema sylvestris, l’huile de nigelle et la berbérine sont des actifs naturels qui permettent d’améliorer considérablement la sensibilité à l’insuline.
Le potentiel de l’extrait de mûrier blanc dans la régulation de la glycémie
Le Reducose®
Saviez-vous que le Reducose®, ou extrait de mûrier blanc, augmente la production de GLP1 ?
Et, notamment, qu’il exerce un effet bénéfique sur la glycémie et l’insulinémie
post-prandiale chez des personnes non-diabétiques (12) et diabétiques ? (13)

Dans l’étude de 2021 chez les non-diabétiques (14), le Reducose® a favorisé une diminution du pic de glucose et d’insuline de 40% après ingestion chez 38 personnes en bonne santé.
Le mûrier blanc est riche en Dioxynojirimycine (DNJ), un imino-sucre ou D-glucose analogue, inhibant physiologiquement les enzymes alpha-glucosidases dans l’intestin grêle.
Ces enzymes digestives sont impliquées dans la digestion terminale des glucides : la transformation des disaccharides en monosaccharides. De ce fait, la digestion et l’assimilation des monosaccharides est plus lente, induisant une baisse de production d’insuline par le biais de GIP et GLP-1.
En effet, le GIP, ou Glucose Insulinotropic Peptide et le GLP-1 ou Glucagon-like Peptide-1, sont des incrétines fabriquées par l’intestin grêle au contact des aliments.
Elles sont responsables de stimuler la production d’insuline.
Le GIP est fabriqué au niveau du duodénum et jéjunum et est très sensible au glucose en tant que tel mais moins aux disaccharides & polysaccharides.
Le GLP-1 est fabriqué au niveau de l’ileum et est stimulé par le glucose, les disaccharides et les polysaccharides. En temps normal, le GIP est responsable de la majorité de la réponse insulinique post-prandiale.
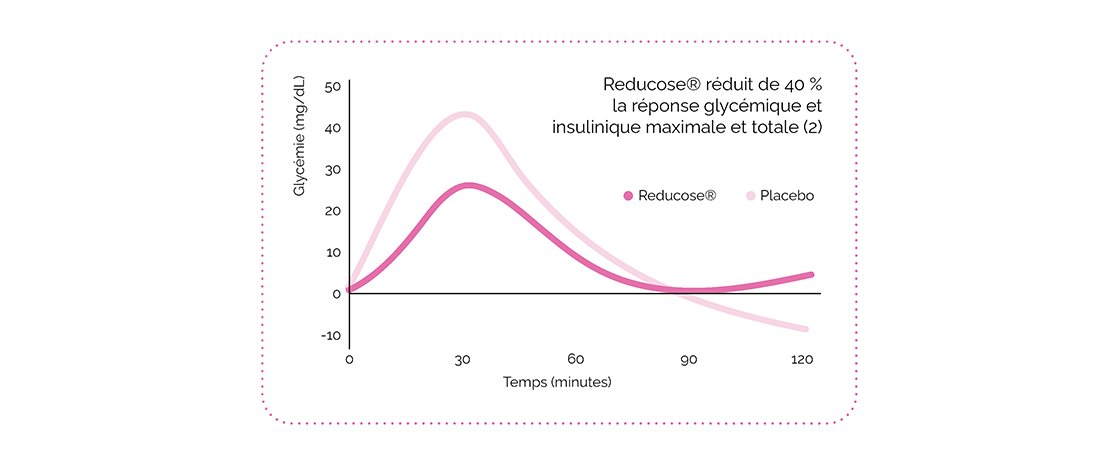
Dans l’étude de 2021, la digestion du sucrose a été différente dans le groupe placebo versus le groupe Reducose®. Dans le groupe placebo, le sucrose a été rapidement transformé en glucose et fructose par les glycosidases de la bordure en brosse, stimulant autant GIP que GLP-1 avec comme conséquence un pic d’insuline important et même une hypoglycémie réactionnelle 2h après.
Dans le groupe Reducose®, le taux plus faible de glucose libéré a essentiellement stimulé le GLP-1 et diminué le GIP, favorisant une baisse du pic de glycémie/insulinémie et augmentant également la satiété dans le temps. En guise de cerise sur le gâteau, la progression des disaccharides non digérés dans le gros intestin a généré un effet prébiotique, favorisant le jeûne entre les repas.
Cela signifie qu’en complément d’un équilibrage alimentaire, le Reducose® favorise une prise en charge intégrative des personnes en surpoids. Contribuant ainsi à diminuer la consommation de sucre, à optimaliser la satiété et à réguler l’insulino-résistance éventuelle.
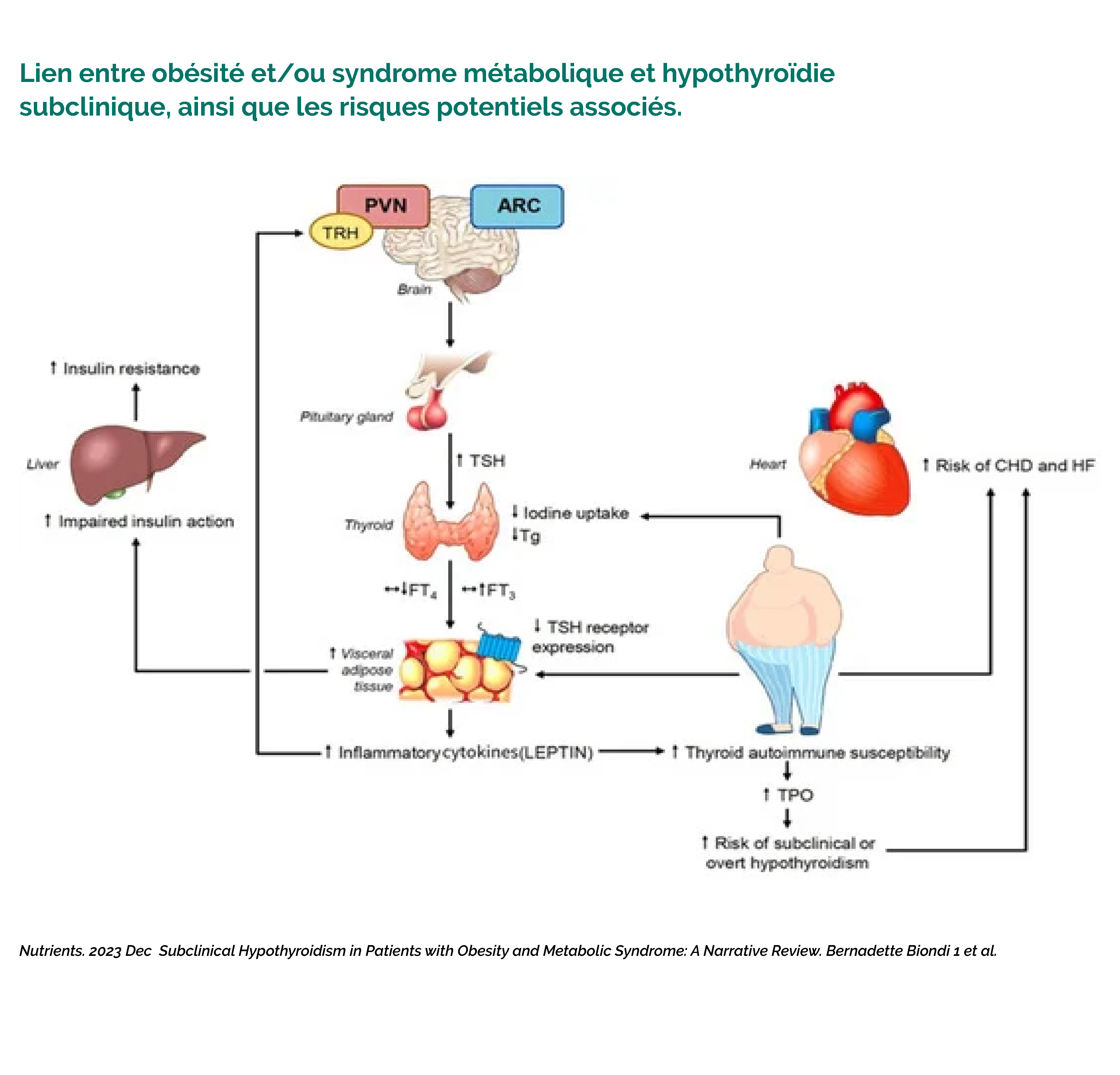
3. Hypothyroïdie (sub)-clinique et le surpoids
Selon une investigation de 2023, de plus en plus d’études scientifiques ont constaté une TSH (Thyroid Stimulating Hormone) plus élevée et un taux de T3/T4 diminué chez les personnes obèses comparées aux personnes ayant un poids normal. (15)
Il a été découvert que le tissu adipeux de personnes obèses exprimait moins de récepteurs TSH ainsi que moins de désiodases (enzymess peroxydaes). D’autant plus que l’inflammation de bas grade est plus élevée en cas de surpoids, augmentant le risque de développer une thyroïdite auto-immune. Ensuite, l’hypothyroïdie est associée à un risque plus élevé d’athérosclérose, de troubles hépatiques et rénaux. Les chercheurs de cette étude suggèrent de traiter l’hypothyroïdie subclinique en fonction de l’IMC et du poids corporel.
Thyroïde, déficit en iode et difficultés à la perte de poids
Parmi les facteurs limitant la perte de poids, on retrouve la notion de carence ou de déséquilibre micro nutritionnel. L’approche individualisée intégrant les particularités de chacun est essentielle.
L’iode est un élément minéral indispensable à l’organisme puisqu’il est essentiel à la synthèse des hormones thyroïdiennes. La physiologie est complexe, dépendant des apports disponibles à l’organisme, des mécanismes de son organification par la thyroïde et de la régulation des pools intra- et extrathyroïdiens. Les pathologies liées à l’iode peuvent globalement se subdiviser en carence d’apport d’iode à la thyroïde, le plus fréquemment par défaut d’apport alimentaire, et en excès d’apport, souvent d’origine iatrogène.
Son expression clinique se traduit par l’apparition d’un dysfonctionnement thyroïdien dont le bilan d’exploration biologique usuel ne permet pas toujours de déterminer la cause.
Une étude en micronutrition, chez 74 patientes résistantes à l’amaigrissement et présentant des signes frustres d’hypothyroïdie fonctionnelle, a montré que 43% de ces patientes présentaient un déficit léger, selon l’OMS, avec une iodurie entre 50 et 100 µg/l et 19% avaient un déficit moyen (50 µg/l).
On parle de carence légère en iode à partir d’une iodurie inférieure à 100 µg/L et de carence sévère si elle est inférieure à 20 µg/L.
Le métabolisme :
- fonctionne au ralenti,
- synthétise également moins d’enzymes digestives,
- place l’organisme dans un état de gastroparésie : ralentissement des mouvements de l’estomac associé à une baisse de leur amplitude.
Régulation de l’appétit
Qu’en est-il de la leptine et de la ghréline ?
Dans 90% des cas, la reprise de poids est récurrente après un régime. (16)
Cela pourrait être dû à un taux plus élevé de leptine et à une diminution de la ghréline ou à une résistance à la leptine. Ces hormones, découvertes dans les années 1990, régulent l’appétit et le taux de graisse corporelle.
La leptine est fabriquée par nos adipocytes et y est stockée. Cette hormone informe le cerveau du niveau de carburant dans le corps ainsi que de la capacité de ce carburant à être transformé en énergie.
Lorsque nous mangeons, la leptine est libérée dans le sang et transmet la sensation de satiété au cerveau ainsi que la quantité d’énergie qui est disponible. La leptine permet donc d’éviter l’ingestion de calories excessives si la satiété est écoutée/respectée. En cas de régime, le corps fabrique moins de leptine. En dessous d’un certain niveau de leptine, le cerveau perçoit cela comme une privation ou famine. Il stimule alors le nerf vague pour augmenter la sensation de faim, diminue le métabolisme et la combustion des graisses. C’est pourquoi il est très important de perdre du poids lentement, idéalement 2 kg par mois, afin que le corps ait le temps d’adapter la sécrétion de leptine et ne perçoit pas cela comme une famine.
Des régimes à répétition, des chocs émotionnels et l’insulino-résistance entre autres pourraient contribuer au développement d’une résistance à la leptine, impliquée dans le surpoids ou obésité persistante. Dans ce cas, le taux de leptine circulante est élevé mais le cerveau perçoit ce taux comme étant faible et la personne ne perçoit plus de signal de satiété.
Réguler les croyances alimentaires, identifier les émotions qui font manger, moduler l’insulino-résistance et favoriser une alimentation riche en antioxydants (resvératrol, quercétine, vitamines A, E, …), oméga-3 (EPA, DHA), fibres et modérée en graisses saturées permettrait d’améliorer la sensibilité à la leptine. (17)
La ghréline exerce une action opposée à la leptine. Elle stimule la production d’hormone de croissance et augmente le taux de graisse corporelle. La ghréline est produite dans l’estomac. La concentration diminue avant le repas et augmente après celui-ci. Elle influence différents centres dans l’hypothalamus, impliqués dans la régulation de l’appétit. Plus le taux de ghréline est élevé, plus nous avons faim. Paradoxalement, les personnes souffrant d’un excès de poids ont des taux de ghréline plus bas. Le mécanisme n’est pas encore tout à fait clair. Lorsque la leptine et le taux d’insuline sont élevés de manière chronique, le taux de ghréline chute. Les scientifiques pensent qu’il s’agit d’une sorte de mécanisme d’adaptation du corps face à l’apport excessif de nourriture, calories et énergie.
Blocages physiologiques
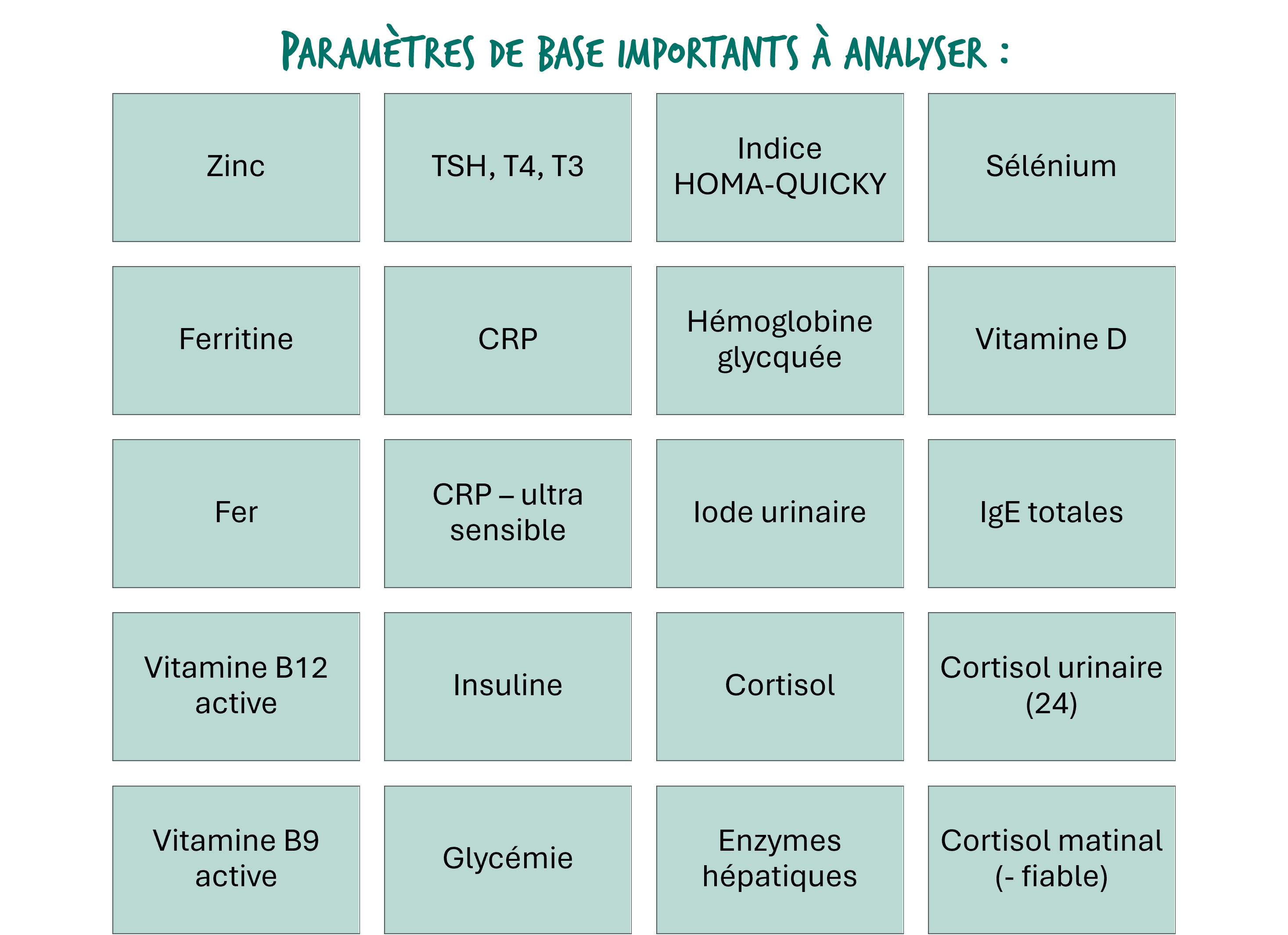
Marqueurs à analyser
Selon les nouvelles avancées en médecine fonctionnelle, une analyse approfondie du terrain à travers la prise de sang peut être complémentaire à l’anamnèse.
Tout cela est bien sûr à personnaliser et est laissé à la libre appréciation du praticien.
Certaines recherches soutiennent l’analyse des éléments suivants en complément des paramètres de base (cfr tableau de droite) :
- Homocystéine
- Lipopolysaccharides LPS
- Anticorps anti-thyroidiens, …
- IgG EBV
- IgG EBNA, CMV, Herpès
- IgA totales
Approche naturelle
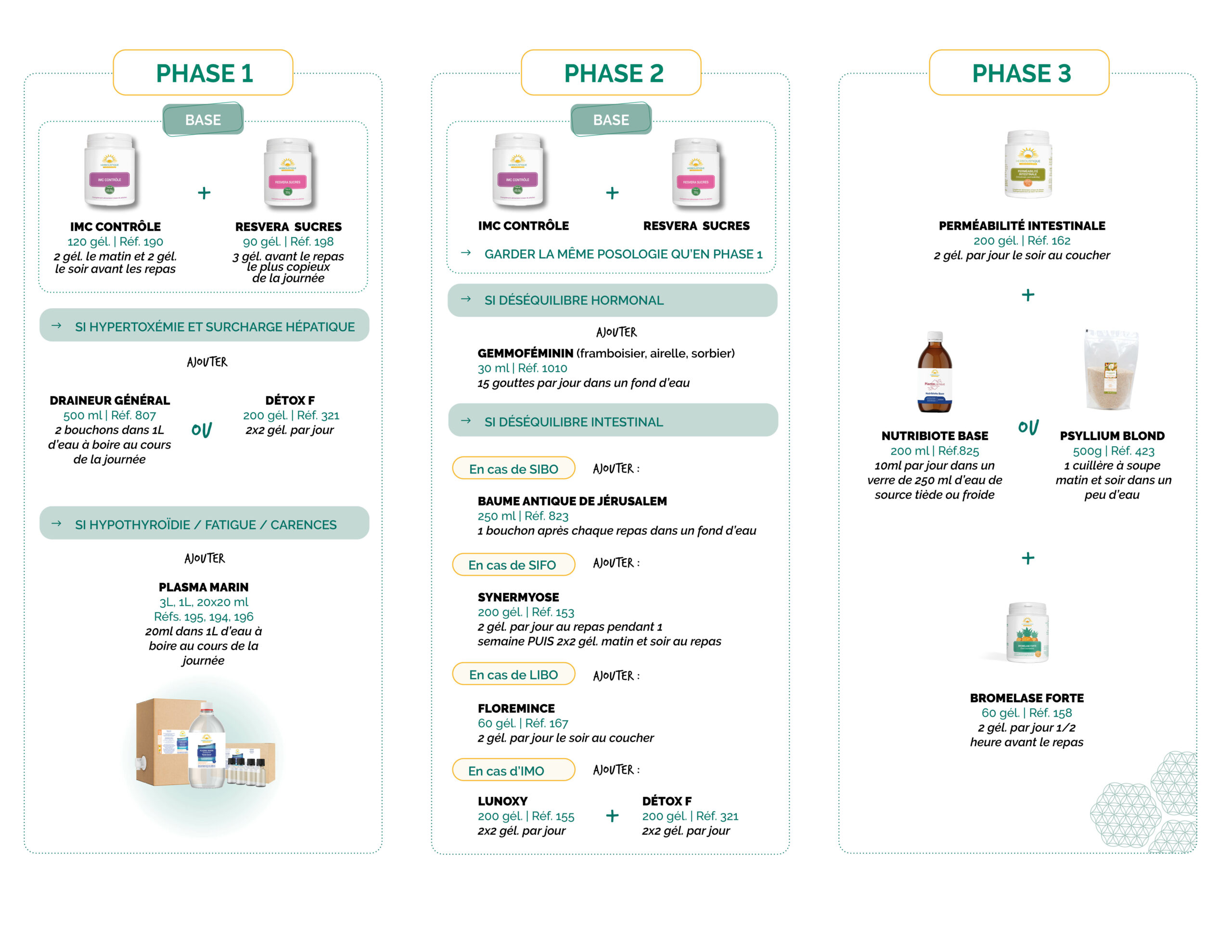
Suggestions de protocoles
Sources :
(1) Crovesy, L. et al. Profile of the gut microbiota of adults with obesity: A systematic review. J. Clin. Nutr. 2020, 74, 1251–62.
(2) Turnbaugh, P.J.et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 2006 ;Flint, H.J. Obesity and the Gut Microbiota. J. Clin. 2011, 45, S128–S132.
(3) Gomes, A.C et al. The additional effects of a probiotic mix on abdominal adiposity and antioxidant Status: A double-blind, randomized trial: Probiotic Mix and Abdominal Adiposity. Obesity 2017 ;Suzumura, E.A et al. Effects of oral supplementation with probiotics or synbiotics in overweight and obese adults: A systematic review and meta-analyses of randomized trials. Rev. 2019, 77, 430–50.
(4) Madrid A.M.et al. Small Intestinal Clustered Contractions and Bacterial Overgrowth: A Frequent Finding in Obese Patients. Dig. Dis. Sci. 2011 ;Fialho A et al. Higher Visceral to Subcutaneous Fat Ratio Is Associated with Small Intestinal Bacterial Overgrowth. Metab. Cardiovasc. Dis. 2016.
(5) Gastroenterol Hepatol (N Y). 2012 Jan; 8(1): 22–28.Intestinal Methane Production in Obese Individuals Is Associated with a Higher Body Mass Index.Robert J. Basser et al.
(6) Jacobs C., Coss Adame E., Attaluri A., Valestin J., Rao S.S.C. Dysmotility and Proton Pump Inhibitor Use Are Independent Risk Factors for Small Intestinal Bacterial and/or Fungal Overgrowth. Aliment. Pharmacol. Ther. 2013.
(7) Couet C, Delarue J, Ritz P, et al. Effect of dietary fish oil on body fat mass and basal fat oxidation in healthy adults. Int J Obes 1997;21:637–43.
(8) NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Shivakumar Chitturi et al, 2002.
(9) BMJ Journal. Relationship of obesity to adipose tissue insulin resistance. Jiajia Jiang et al.
(10) Dig Dis Sci. . 2020 May;Obesity and Risk of Small Intestine Bacterial Overgrowth: A Systematic Review and Meta-Analysis.Karn Wijarnpreecha et al.
(11) The role of small intestinal bacterial overgrowth in obesity and its related diseases. Qinyan Yao et al, 2023, Biochemical pharmacology.
(12) Pariyarath Sangee Tha Tondre et al. Mulberry leaf extract improves glycaemic response and insulaemic response to sucrose in healthy subjects.
(13) Complement Ther Med. 2017 Jun: Impact of mulberry leaf extract on type 2 diabetes (Mul-DM): A randomized, placebo-controlled pilot study. Daniel M Riche et al.
(14) Pariyarath Sangee Tha Tondre et al. Mulberry leaf extract improves glycaemic response and insulaemic response to sucrose in healthy subjects.
(15) 2023 Dec Subclinical Hypothyroidism in Patients with Obesity and Metabolic Syndrome: A Narrative Review. Bernadette Biondi 1 et al.
(16) Raian et al. Physiological and Epigenetic features of yoyo dieting and weight control.
(17) Nutr. Food Res. 2016, Modulation of leptin resistance by food compounds. Gerard Aragones.
Document réservé à l’usage des praticiens de santé.
