
Le système digestif est souvent le premier à souffrir d’une insomnie, d’un stress chronique, d’une anxiété ou d’une dépression. Les liens entre le microbiote, l’intestin et le cerveau ne sont plus à prouver et se font de plus en plus nombreux.
Le microbiome intestinal influence la santé mentale, le sommeil et la mémoire et inversement. Ce mécanisme bidirectionnel est plus communément appelé : l’axe microbiome-intestin-cerveau.
Cette communication à double sens entre le cerveau et le microbiote intestinal passe via diverses voies : neuronale, endocrinienne, immunitaire et métabolique.
Parcourons ensemble les dernières avancées scientifiques et les voies à explorer afin d’apporter des solutions concrètes et efficaces.
L’axe cerveau-intestin n’est pas qu’une relation à sens unique et doit être envisagé comme tel pour une approche systémique efficace. Il est essentiel de comprendre la composition et les variations du microbiote, ainsi que ses grands influenceurs.
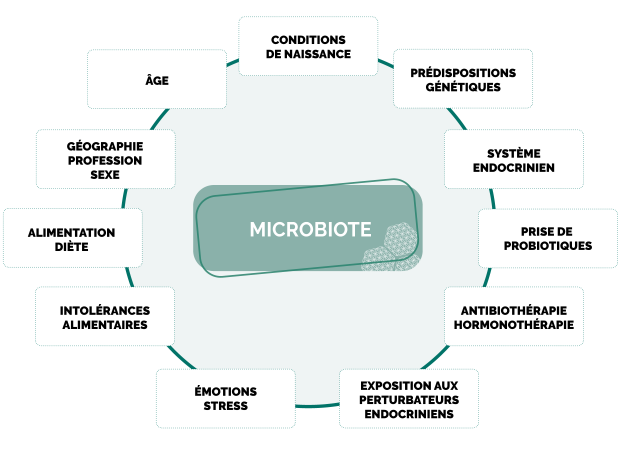
Le lien cerveau-intestin
Une communication bidirectionnelle
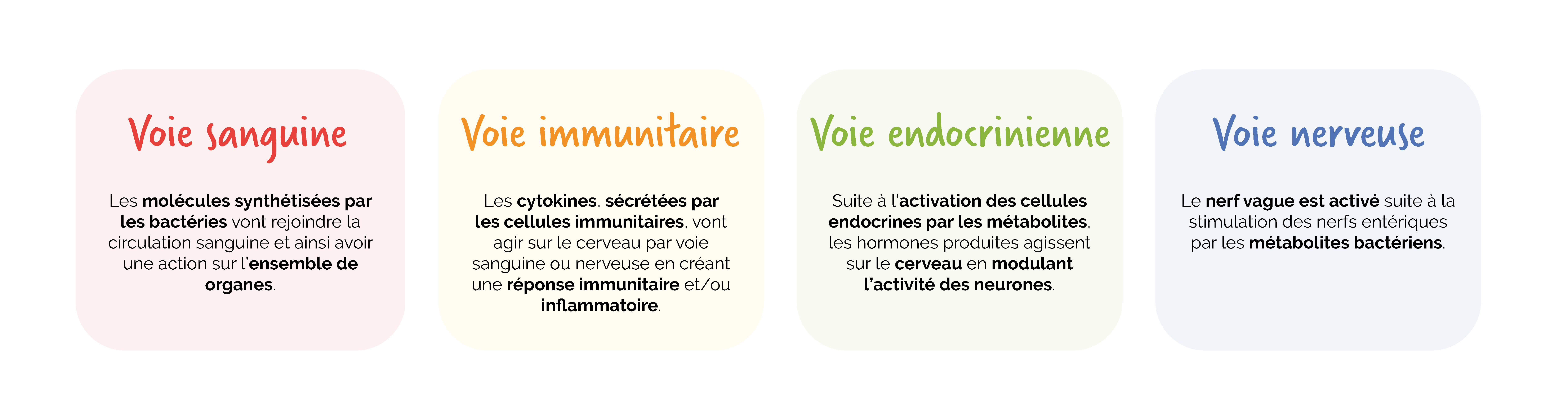
Les messagers du dialogue bidirectionnel entre le microbiote, le cerveau et l’intestin incluent des médiateurs neuronaux, métaboliques, endocriniens et immunitaires, sensibles à divers signaux environnementaux, notamment ceux provenant des nutriments et des composants du microbiote intestinal. En réponse à des stimuli chimiques et/ou mécaniques, ces molécules peuvent pénétrer dans la circulation systémique, atteindre le système nerveux central (SNC) ou agir localement en activant des terminaisons vagales afférentes situées à proximité de l’intestin.
De plus, il existe une communication importante entre le système nerveux entérique (SNE) et le système immunitaire. Cette harmonie repose sur la libération de médiateurs solubles, tels que les cytokines, chimiokines, neurotransmetteurs, et sur les interactions avec les cellules immunitaires innées, y compris les mastocytes, macrophages et cellules lymphoïdes innées (ILC).
Les bactéries intestinales interviennent de deux manières :
- Soit par les molécules qui les composent incluant des composants structurels des bactéries elles-mêmes, comme les lipopolysaccharides (LPS), des protéines, ou des fragments d’ADN bactérien ;
- Soit par celles qu’elles produisent, notamment les acides gras, en particulier les acides gras à chaîne courte comme l’acétate, le propionate, et le butyrate.
Toutes ces substances atteignent le cerveau par diverses voies de communication : via la circulation sanguine, et via les systèmes immunitaires et endocriniens de l’intestin. Enfin, elles empruntent aussi la voie nerveuse en influençant l’activité du nerf vague, soit par un signal nerveux ascendant de l’intestin vers le cerveau (voie sensitive), soit par un signal descendant du cerveau vers l’intestin (voie motrice).
Un dialogue direct entre microbiote intestinal et cerveau
À l’Institut Pasteur, des équipes de neurobiologistes, immunobiologistes et microbiologistes ont collaboré pour explorer comment les bactéries intestinales influencent directement l’activité neuronale. Ils ont étudié le récepteur NOD2 (Nucleotide Oligomerization Domain), présent dans les cellules immunitaires, qui détecte les muropeptides, des composés dérivés des parois bactériennes du microbiote intestinal.
Utilisant des techniques d’imagerie cérébrale chez la souris, ils ont découvert que le récepteur NOD2 est exprimé dans des neurones du cerveau, notamment dans l’hypothalamus. Ces neurones montrent une diminution de leur activité électrique lorsqu’ils rencontrent des muropeptides bactériens. Fait surprenant, ce sont les neurones eux-mêmes qui détectent ces muropeptides, contrairement à la détection généralement attribuée aux cellules immunitaires. Les chercheurs ont établi que le NOD2 se lie aux mêmes muropeptides, à la fois dans le système immunitaire intestinal et dans le cerveau, suggérant que ces fragments de paroi bactérienne circulent du système digestif vers le cerveau où ils sont reconnus par les neurones hypothalamiques. (1)(2)
L’intestin, miroir de nos angoisses, notre sommeil et nos troubles de la mémoire
Depuis une dizaine d’années, les chercheurs ont montré que la dysbiose intestinale entraîne un déséquilibre de la symbiose hôte-microbiote avec l’émergence de maladies chroniques, telles que les maladies psychiatriques, la dépression, le syndrome de fatigue chronique ainsi que les troubles du sommeil, de la mémoire et de la concentration.
ZOOM SUR LA SANTÉ MENTALE

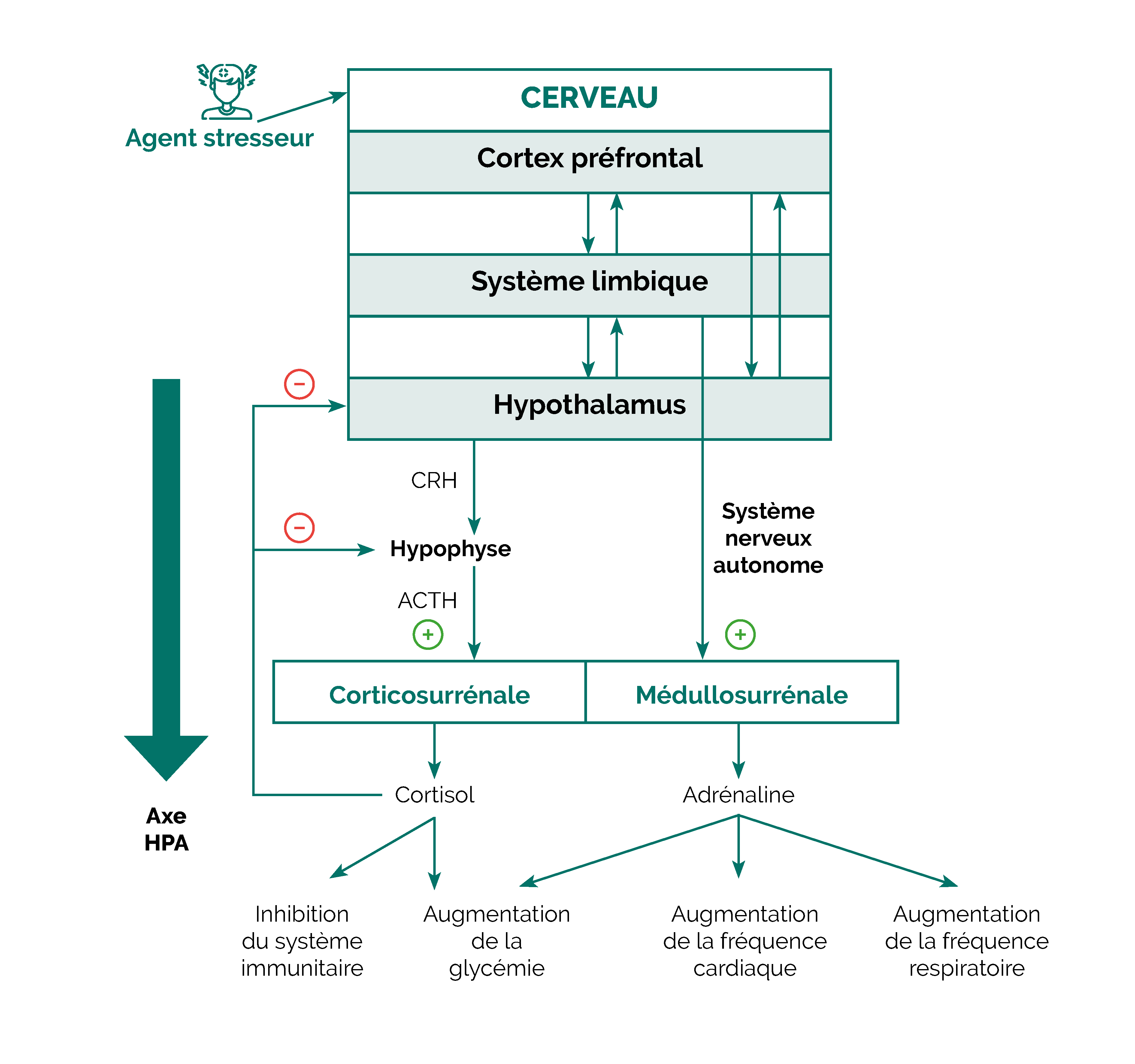
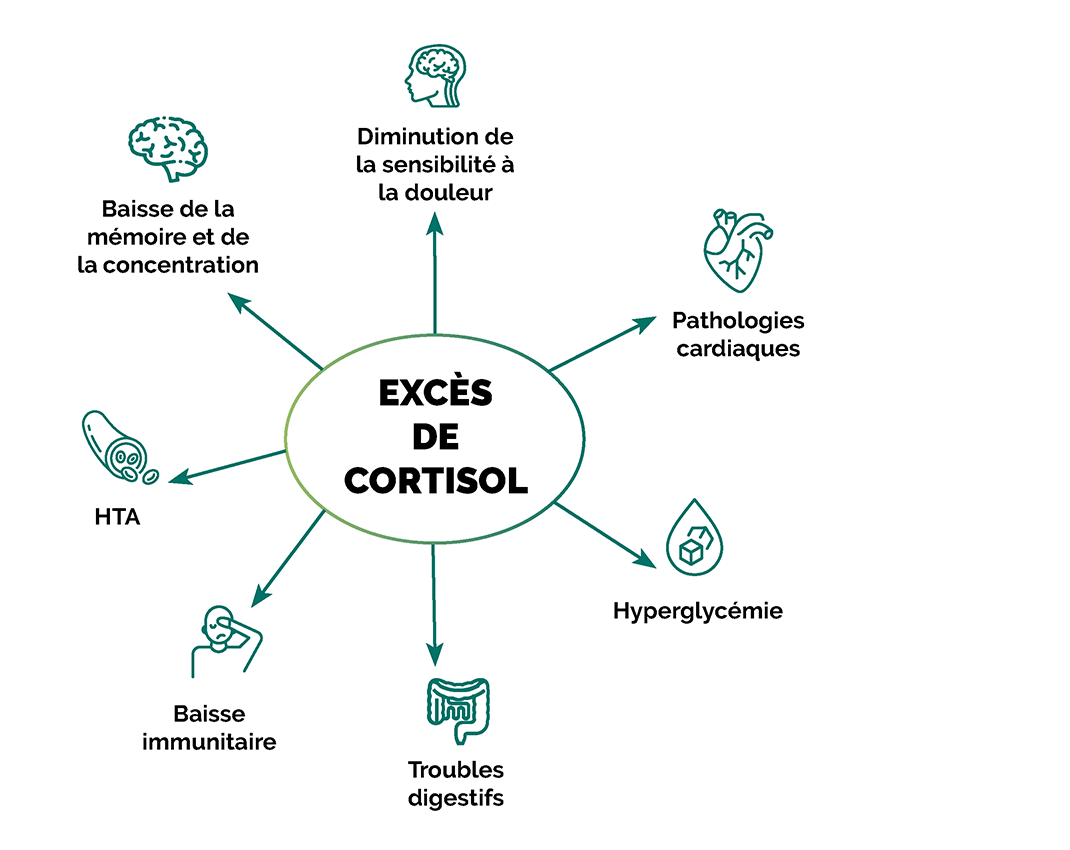
L’impact du cortisol
Le stress active le système immunitaire et la réponse inflammatoire, de manière à préparer l’organisme à « affronter et combattre » toute agression potentielle.
La réponse au stress active l’axe hypothalamo-hypophyso-surrénalien (HPA) et entraine l’augmentation de la sécrétion de la CRH (corticotropin-releasing hormone) puis de l’ACTH (adrenocorticotropic hormone) et enfin de cortisol par les corticosurrénales.
Le cortisol fonctionne comme un « switch » de sécurité pour freiner l’activation excessive de la réaction inflammatoire.
Le stress affecte le cerveau et le système gastro-intestinal de manière bidirectionnelle :
- De haut en bas, le système nerveux central (SNC) déclenche une réponse via l’axe HPA (hypothalamo-hypophyso-surrénalien) et le système nerveux autonome (SNA), entraînant une augmentation de la sécrétion de cortisol, d’adrénaline et de noradrénaline. De plus, le facteur de libération de la corticotropine (CRF) intensifie le comportement anxieux, les douleurs abdominales, les sécrétions coliques, les contractions musculaires (motilité) et augmente la perméabilité de la muqueuse intestinale.
- De bas en haut, sous l’effet du stress, l’inflammation gastro-intestinale provoque une activation intense des neurones sensoriels de l’intestin, ce qui entraîne une hyperactivité sensorielle. Cette hyperactivité entretient l’excitation de l’axe HPA et du système orthosympathique.
L’impact du glutamate
Glutamate et cortisol sont deux neurotransmetteurs importants dans le corps et, bien qu’ils soient impliqués dans des systèmes différents, ils sont liés entre eux, particulièrement dans le contexte de la réponse au stress et des fonctions cérébrales.
Une élévation prolongée du cortisol, comme celle observée lors d’un stress chronique, peut augmenter la libération de glutamate, entraînant des effets neurobiologiques potentiellement nuisibles.
L’excito-toxicité du glutamate déclenche l’inflammation, engendrant des lésions nerveuses et l’apoptose des neurones. Cette situation peut endommager les neurones et est impliquée dans des conditions neurodégénératives comme la maladie d’Alzheimer.
Pour tenter de réduire les dommages, le cerveau augmente la production d’opioïdes, molécules ressemblant à l’opium. En outre, des niveaux élevés de glutamate épuisent les niveaux de glutathion (GSH), antioxydant central de la détoxification hépatique. Cette diminution de GSH entraine une augmentation des médiateurs inflammatoires et contribue à exacerber la perméabilité intestinale.
Quelles solutions envisagées ?
FOCUS SUR LES PROBIOTIQUES
Les probiotiques agiraient sur l’axe intestin-cerveau, une voie de communication bidirectionnelle entre les deux organes. Ils pourraient influer sur la fonction cérébrale en modifiant la neurotransmission ainsi que les signaux hormonaux et immunologiques. Certaines bactéries intestinales peuvent aussi produire des neurotransmetteurs, comme la sérotonine qui joue un rôle important dans la régulation de notre humeur. Des études (3)(4) indiquent que les probiotiques auraient un effet positif sur la réduction des symptômes de la dépression.
De ce concept ont émergé les psychobiotiques qui représentent une approche novatrice pour la gestion des troubles liés au stress. Des études précliniques (5)(6) récentes ont identifié la souche Bifidobacterium longum comme un psychobiotique potentiel ayant un impact sur les comportements liés au stress, la physiologie et les performances cognitives.
Ce probiotique pourrait modifier la composition du microbiote intestinal, créant un environnement plus favorable qui influence la production de neurotransmetteurs tels que la sérotonine et le GABA. Une étude de 2022 a révélé que Bifidobacterium longum est capable de moduler l’activité cérébrale en impactant l’axe HPA, un système central dans la réponse au stress.
Il a également été démontré que Bifidobacterium longum peut réduire l’inflammation systémique, souvent liée à la dépression et à d’autres troubles psychiatriques. Une étude de 2023 a montré que ce probiotique diminue les marqueurs inflammatoires chez des patients souffrant de troubles anxieux, ce qui pourrait en partie expliquer ses effets bénéfiques sur la santé mentale.
Rappelons que … le stress a une signification beaucoup plus large.
L’inflammation, les infections microbiennes, les blessures, l’exposition à diverses toxines, les rayonnements, le stress oxydatif, l’alimentation ultra transformées, l’entraînement physique excessif, la glycation, … sont reconnus comme un stress par l’organisme humain. Tous ces facteurs peuvent induire une augmentation de la porosité intestinale avec ses conséquences immunitaires et psychopathologiques.
- Le potentiel du Z PSYCHOBIOTIC
Cette synergie associe 9 souches de ferments (dont le Bifidobacterium longum) avec des vitamines du groupe B (B1, B2 et B6), du lithotame (qui favorise l’équilibre acido-basique) et du brahmi (Bacopa monnieri).
Une étude de 2021 (7)(8) a mis en lumière le fait que le Bacopa monnieri possède des propriétés antioxydantes et anti-inflammatoires qui peuvent protéger les neurones contre les dommages oxydatifs, un mécanisme clé dans la progression des maladies neurodégénératives.
D’autres études suggèrent qu’il réduit les symptômes d’anxiété et de dépression chez des patients atteints de troubles anxieux généralisés.
Ce produit unique associe les bienfaits du brahmi à ceux des probiotiques.
- Le potentiel du protéolysat de poisson
Un hydrolysat de poisson est composé notamment d’acides aminés et concentré en oligopeptides facilement assimilables.
Le terme protéolysat de poisson est souvent utilisé de manière interchangeable avec hydrolysat de poisson. Cependant, il met l’accent sur le processus de protéolyse, c’est-à-dire la dégradation des protéines par des enzymes appelées protéases.
Ce terme est plus spécifique à la dégradation des protéines par des enzymes protéolytiques. Il est techniquement un type d’hydrolysat.
Les recherches sur les protéolysats de poisson et la santé mentale sont encore émergentes, mais quelques études récentes suggèrent un potentiel intéressant en raison de leurs propriétés bioactives, notamment leurs effets anti-inflammatoires, antioxydants et neuroprotecteurs.
Des études (9)(10) se sont concentrées sur les effets du protéolysat de poisson sur la régulation des neurotransmetteurs. Les résultats ont montré que certains peptides issus du protéolysat pouvaient moduler l’activité des récepteurs GABAergiques dans le cerveau, ce qui pourrait expliquer les effets anxiolytiques observés. Ces récepteurs jouent un rôle crucial dans la régulation de l’anxiété et des réponses au stress.
ZOOM SUR LE SOMMEIL

L’augmentation des problèmes de sommeil et d’insomnie à travers le monde pousse à la recherche et l’innovation en matière de traitements pour y remédier. De plus en plus d’études s’intéressent au microbiome intestinal et à son influence sur la qualité du sommeil.
L’incidence entre le manque de sommeil et la diversité du microbiote intestinal et inversement, est de plus en plus mise en avant en tant que mécanisme bidirectionnel. En effet, le microbiome influence la production de métabolites et de composés aux propriétés neuroactives et immunomodulatrices, comme les acides gras à chaîne courte, les acides biliaires secondaires et les neurotransmetteurs, qui exercent une influence directe sur la santé de manière générale et, par conséquent, sur le sommeil. Plusieurs de ces substances sont reconnues pour favoriser l’éveil (comme la sérotonine, l’épinéphrine, la dopamine, l’orexine, l’histamine, l’acétylcholine et le cortisol) ou le sommeil (comme l’acide gamma-aminobutyrique et la mélatonine). (11)
À l’inverse, la dysbiose intestinale est associée à un sommeil fragmenté et de courte durée, ainsi qu’à l’activation possible de l’axe HPA (hypothalamo-hypophyso-surrénalien). Les déséquilibres métaboliques causés par le manque de sommeil pourraient favoriser la prolifération de certaines bactéries intestinales, ce qui peut ensuite entraîner de la fatigue.
FOCUS SUR LES PROBIOTIQUES
Certains traitements pro-, pré- et postbiotiques peuvent influencer la qualité du sommeil, le stress et l’anxiété :
Les probiotiques et postbiotiques montrant des résultats prometteurs sur le sommeil (basé sur la revue de littérature de J.E. Haarhuis et al, 2022) :
- Lacticaseibacillus rhamnosus: amélioration de la qualité du sommeil
- Lactobacillus helveticus : amélioration de la qualité du sommeil, réduction de la latence à l’endormissement et du nombre de réveils nocturnes.
- Lactobacillus gasseri en postbiotique (souche inactivée par la chaleur) : réduction de la latence à l’endormissement et du nombre de réveils noctures et baisse du cortisol salivaire
Influence des AGCC et AG sur le rythme circadien
Le microbiote intestinal et ses métabolites suivent un rythme circadien influencé par le cycle d’alimentation et de jeûne. Des facteurs tels que le décalage horaire, une alimentation inappropriée et des anomalies des gènes de l’horloge biologique peuvent perturber ce rythme. Cependant, une alimentation saine à heures régulières peut aider à le rétablir. Les métabolites produits par le microbiote intestinal influencent les gènes de l’horloge et la durée du sommeil, impactant ainsi la composition corporelle.
Les AGCC comme l’acétate, le propionate et le butyrate influencent l’expression des gènes de l’horloge et le schéma du sommeil. Ils varient au cours de la journée, avec des concentrations plus élevées le matin, qui diminuent au cours de la journée.
Leone et al. (12) ont découvert qu’un déficit en métabolites microbiens pourrait altérer des composantes génétiques de l’horloge circadienne centrale et hépatique. Ces changements ont été observé in vitro, au niveau de l’expression des gènes Bmal1 et Per2 dans les cellules hépatiques après l’administration d’acétate de sodium et de butyrate de sodium. Ces 2 gènes sont des marqueurs des réseaux de régulation métabolique de l’horloge circadienne du foie.
D’autres travaux (13) qui ont été réalisés ont montré que l’injection intraportale de butyrate entraîne une augmentation de 70% du sommeil lent ou profond chez les souris. Cependant, l’injection systémique sous-cutanée et intrapéritonéale de butyrate n’a eu aucune influence sur le sommeil. Les conclusions ont mis en avant que les effets inducteurs de sommeil du butyrate sont probablement médiés par des mécanismes sensoriels hépatiques.
De plus, les acides biliaires (AB) non conjugués exerceraient aussi une influence sur l’horloge biologique car ils augmenteraient l’expression des gènes périphériques Per et Cry situés dans l’iléon et le côlon chez les souris. (14)
Influence de AGCC sur le taux de cortisol
En outre, une étude clinique randomisée de 2020 réalisée par Dalile et al. sur 66 hommes (15), a montré que l’administration d’acides gras à chaines courtes permet de moduler la réactivité de l’axe HPA.
Ils ont constaté une diminution progressive des niveaux de cortisol salivaire face à une situation de stress psychosocial, chez les deux groupes auxquels on a administré des AGCC par rapport au placebo.
Influence de AGCC sur le système immunitaire
D’autres recherches ont montré que les acides gras à chaîne courte (AGCC) possèdent des propriétés immunomodulatrices. Ils peuvent réduire la production de cytokines pro-inflammatoires tout en favorisant les cytokines anti-inflammatoires et la différenciation des cellules T.
En renforçant l’intégrité de la paroi intestinale, les AGCC empêchent ces médiateurs inflammatoires de pénétrer dans la circulation systémique et de stimuler l’axe HPA (via le nerf vague). Par conséquent, ils aident à prévenir la production de neurotransmetteurs et d’hormones favorisant l’éveil, comme la noradrénaline et le cortisol. Des niveaux élevés de cytokines pro-inflammatoires peuvent également contribuer à la fragmentation du sommeil profond et à la suppression du sommeil paradoxal.
Quelles solutions envisagées ?
- Le potentiel de NUTRIBIOTE sommeil
Les prébiotiques ont également démontré des effets de réduction du stress et de promotion du sommeil. Cette amélioration pourrait s’expliquer par l’augmentation des bifidobactéries, qui se nourrissent des prébiotiques et de AGCC qui sont les produits finaux métaboliques de certaines bactéries bénéfiques de la flore intestinale (notamment les lactobacilles et les bifidobactéries). (5)(6)
Le NUTRIBIOTE Sommeil est un nutribiotique de haute valeur biologique qui permet la revitalisation des nutriments et la régulation enzymatique. Il est associé à 5 plantes traditionnellement utilisées pour améliorer la qualité du sommeil : mélisse, passiflore, lotier, coquelicot, escholtzia.
Il s’intègre dans la gamme Piantolistique, utilisant le procédé exclusif de fabrication PIANTO associé à une eau vitalisée par la méthode Plocher.
Il associe 5 extraits de végétaux avec des nutriments et prébiotiques issues de la fermentation de la levure lysée Saccharomyces Cerevisae.
La fabrication PIANTO est un processus en 3 étapes (fermentation, lyse et concentration) qui permet de garantir un concentré unique de nutriments essentiels.
- La fermentation de la levure lysée (Saccharomyces Cerevisae) : la méthode produit et potentialise de nombreux nutriments, naturellement présents dans la levure, comme les vitamines B1, B2, B3 et B6, oligo-éléments tels que le zinc, le sélénium organique, le manganèse et le molybdène et des puissants antioxydants comme le glutathion et la sélénométhionine (sélénium organique). La levure apporte aussi deux glucides prébiotiques : l’alpha-mannane et le bêta-glucane.
- La lyse cellulaire : la libération des protéines produites par des organismes tels que les levures augmentent leur biodisponibilité. Les membranes cellulaires rompues deviennent des prébiotiques bénéfiques pour les bactéries intestinales.
- La concentration : la filtration élimine les débris cellulaires offrant une biodisponibilité maximale. Grâce aux micronutriments apportés par le levure pré-lysée, l’efficacité des plantes se voit augmentée.
Le NUTRIBIOTE Sommeil est un complément micronutritionel potentialisé, favorisant un environnement optimal de l’axe intestin-cerveau dans une optique d’amélioration de la qualité du sommeil.
ZOOM SUR LA MÉMOIRE

Mémoire et synapses stressées
La mémoire est la capacité d’un organisme, notamment du cerveau humain, à enregistrer, conserver et récupérer des informations et des expériences passées. Elle est avant tout le résultat de la façon dont les neurones communiquent entre eux.
Trois principaux types de cellules cérébrales travaillent en équipe pour maintenir la connectivité globale entre les neurones dans le cerveau et une homéostasie acceptable : les neurones excitateurs, les neurones inhibiteurs, les cellules gliales.
La qualité des connexions inter neuronales, et donc des synapses, joue un rôle dans les capacités mémorielles.
Les synapses excitatrices du cerveau, qui utilisent le glutamate comme principal neurotransmetteur, représentent une cible cruciale pour l’action du stress et de ses médiateurs. De plus en plus de preuves suggèrent que le stress, ainsi que les médiateurs hormonaux et neurochimiques associés (en particulier les glucocorticoïdes), induit des changements dans la libération, la transmission et le métabolisme du glutamate dans les zones cérébrales corticales et limbiques, influençant ainsi le traitement et le comportement cognitif et émotionnel.
En d’autres termes, les hormones de stress et les glucocorticoïdes peuvent donc endommager les fonctions cognitives et contribuer à l’altération des structures cérébrales. (16)(17)
Selon l’âge, le sexe, la durée et le type de stress ressenti, le stress peut induire des modifications nocives et inadaptées du tissu cérébral, qui ont été associées au développement de troubles neuropsychiatriques.
Dans des situations de stress sévère ou chronique, le système immunitaire est intensément stimulé, et les cellules gliales et autres cellules immunitaires du cerveau modifient leur morphologie et leur fonction et sécrètent des niveaux élevés de cytokines pro-inflammatoires.
Des progrès ont également été réalisés sur le lien entre le stress et le dysfonctionnement chronique des cellules gliales, qui entraîne des niveaux élevés de glutamate extracellulaire aux effets neurotoxiques. (18) Cela conduit à une réduction de la densité des astrocytes et à une diminution des interneurones Gabaergiques.
Mémoire et perméabilité intestinale
Le lien entre le déclin cognitif et la perméabilité intestinale est étudié à travers la communication bidirectionnelle entre le système digestif et le système nerveux central.
Des perturbations au niveau intestinal peuvent influencer la santé mentale et cognitive.
- Une augmentation de la perméabilité intestinale peut conduire à une inflammation systémique. Cette inflammation peut affecter le cerveau, contribuant à des troubles cognitifs, voire à des maladies neurodégénératives comme la maladie d’Alzheimer.
- Un déséquilibre dans le microbiote intestinal, souvent associé à une perméabilité intestinale, peut également influencer la production de neurotransmetteurs et d’autres molécules neuroactives, ce qui peut altérer la fonction cognitive.
- Les bactéries intestinales pathogènes, lorsque la barrière intestinale est compromise, peuvent produire des toxines qui pénètrent dans la circulation sanguine et atteignent le cerveau, exacerbant les dommages neuronaux.
La relation est complexe et bidirectionnelle, puisque le déclin cognitif peut, inversement, contribuer à la perméabilité intestinale.
Le déclin cognitif, notamment dans des conditions comme la démence ou la maladie d’Alzheimer, est souvent associé à un stress chronique. Ce stress peut activer l’axe hypothalamo-hypophyso-surrénalien (HHS), entraînant une production accrue de cortisol, une hormone du stress. (19)(20)
Le cortisol en excès peut affaiblir la barrière intestinale, augmentant ainsi sa perméabilité.
Le déclin cognitif est souvent accompagné de dysrégulations du système nerveux autonome, qui contrôle les fonctions involontaires du corps, y compris la motilité intestinale et la sécrétion de mucus protecteur. Ces altérations peuvent compromettre l’intégrité de la barrière intestinale. (21)(22)
Le potentiel de la Klamath
La Klamath est particulièrement appréciée pour sa richesse en protéines, vitamines, minéraux et antioxydants tels que la phycocyanine. Elle contient également de la phényléthylamine (PEA), un composé naturel qui agit comme neurotransmetteur et neuromodulateur. La PEA est connue pour stimuler la libération de dopamine, ce qui peut améliorer l’humeur, l’attention et la motivation. Cette stimulation de la dopamine pourrait avoir des effets bénéfiques sur la santé mentale, notamment dans les cas de dépression ou de troubles de l’humeur où les niveaux de dopamine sont souvent perturbés.
Certaines recherches suggèrent que la Klamath possède des effets neuroprotecteurs, notamment en réduisant l’inflammation neuronale et le stress oxydatif. (23)
En apportant des nutriments essentiels pour le cerveau, elle pourrait améliorer l’humeur, la clarté mentale et la mémoire. De plus, sa teneur en chlorophylle est associée à des bienfaits potentiels contre le déclin cognitif.
Grâce à ses propriétés antioxydantes, la Klamath aide à neutraliser les radicaux libres, à réduire l’inflammation systémique (y compris celle qui touche le cerveau), à soutenir la détoxification, à améliorer l’oxygénation cellulaire et à favoriser l’équilibre de la floreintestinale. Toutes ces propriétés contribuent à un environnement propice à la bonne santé cognitive.
Quelles solutions envisagées ?
- Le potentiel du BACOGIT
Cette synergie associe du brahmi (Bacopa monnieri) avec de la centella (Centella asiatica), de la laitance de poisson, des vitamines du groupe B, vitamine E, du zinc, sélénium, de la taurine et du magnésium.
Les composés de la Centella Asiatica semblent exercer des effets neuroprotecteurs en modifiant les niveaux de neurotransmetteurs et en protégeant les neurones contre les dommages oxydatifs. (24)(25)
Les principaux constituants bioactifs de C. asiatica sont les glycosides triterpénoïdes pentacycliques, l’asiaticoside et le madecassoside, ainsi que leurs aglycones correspondants, l’acide asiatique et l’acide madecassique.
L’asiaticoside et le madecassoside offrent une large gamme de propriétés pharmacologiques, notamment neuroprotectrices, cardioprotectrices, hépatoprotectrices, de cicatrisation des plaies, anti-inflammatoires, antioxydantes, antidépresseurs, anxiolytiques, antifibrotiques, anti-tumorales et immunomodulatrices.
APPROCHE NATURELLE
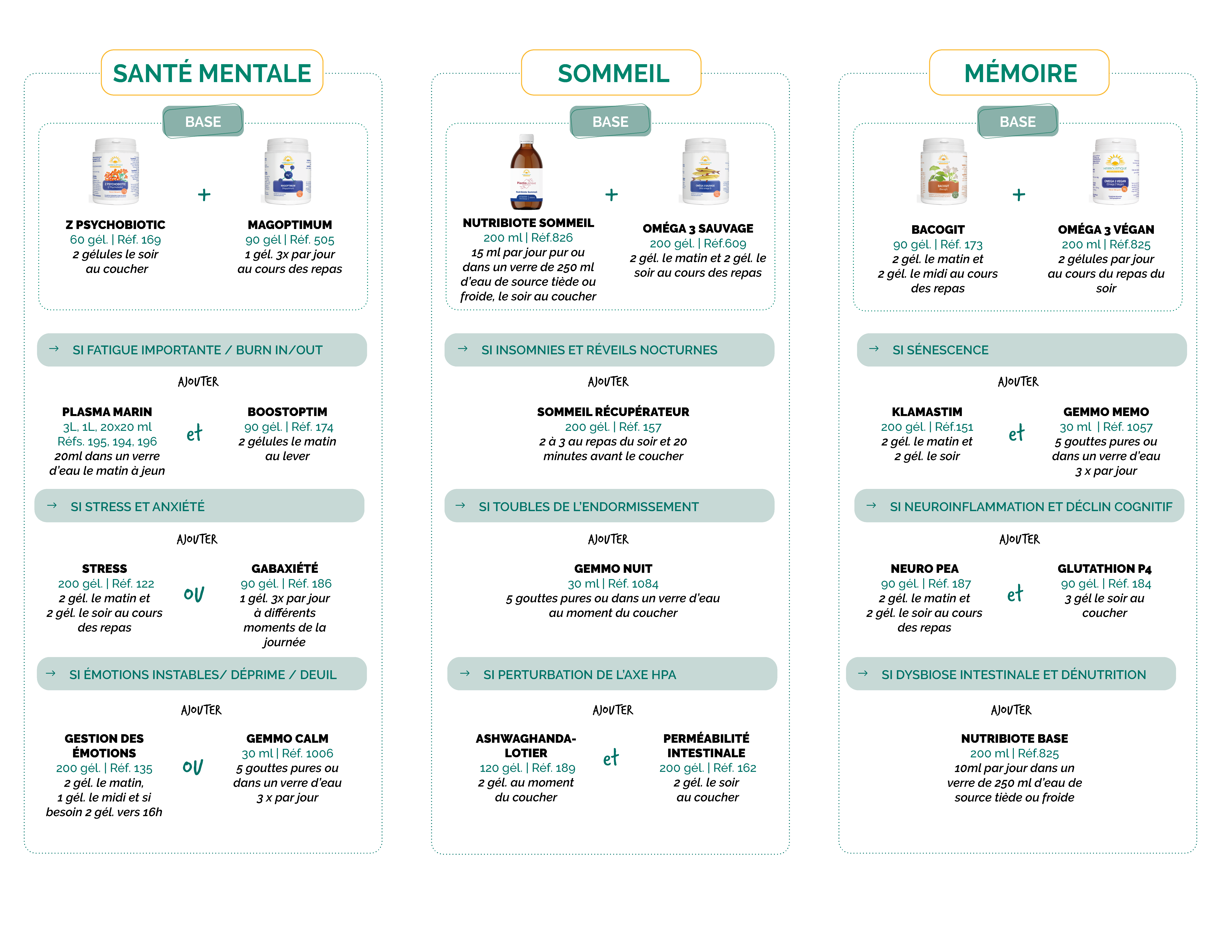
Suggestions de protocoles
Sources :
(1) Rothschild, D., Weissbrod, O., Barkan, E., Korem, T., Zeevi, D., Costea, P. I., … & Segal, E. (2022). Environment dominates over host genetics in shaping human gut microbiota. Science, 375(6586), 277-283. https://doi.org/10.1126/science.abj3986
(2) Institut Pasteur. (2022, 15 avril). Décryptage d’un dialogue direct entre le microbiote intestinal et le cerveau. https://www.pasteur.fr/fr/espace-presse/documents-presse/decryptage-dialogue-direct-entre-microbiote-intestinal-cerveau
(3) Jiang, H., Ling, Z., Zhang, Y., Mao, H., Ma, Z., Yin, Y., … & Ruan, B. (2015). Altered fecal microbiota composition in patients with major depressive disorder. Brain, Behavior, and Immunity, 48, 186-194. DOI: 10.1016/j.bbi.2015.03.016
(4) Kazemi, A., Noorbala, A. A., Azam, K., & Eskandari, M. H. (2019). Effect of probiotic and prebiotic vs placebo on psychological outcomes in patients with major depressive disorder: a randomized clinical trial. Journal of Neurogastroenterology and Motility, 25(4), 378-388. DOI: 10.5056/jnm19051
(5) Steenbergen, L., Sellaro, R., van Hemert, S., Bosch, J. A., & Colzato, L. S. (2015). A randomized controlled trial to test the effect of multispecies probiotics on cognitive reactivity to sad mood. Brain, Behavior, and Immunity, 48, 258-264. DOI: 10.1016/j.bbi.2015.04.003
(6)Allen, A. P., Hutch, W., Borre, Y., Kennedy, P. J., Temko, A., Boylan, G., … & Cryan, J. F. (2016). Bifidobacterium longum 1714 as a translational psychobiotic: Modulation of stress, electrophysiology and neurocognition in healthy volunteers. Translational Psychiatry, 6(11), e939. https://doi.org/10.1038/tp.2016.191
(7) Shetty, S. K., Rao, P. N., U S, Raj, A., KS, S., SV, S. (2021). The effect of Brahmi (Bacopa monnieri) on depression, anxiety, and stress during Covid-19. European Journal of Integrative Medicine, 48, 101898. DOI: 10.1016/j.eujim.2021.101898.
(8) Sathyanarayanan, A., Thomas, T., & Joy, S. (2013). Bacopa monnieri as an anxiolytic and antidepressant therapy for patients with generalized anxiety disorder: A randomized, controlled trial. Phytomedicine, 20(4), 337-345.
(9) Zhao, Y., Yang, J., & Zhao, L. (2021). Fish protein hydrolysates modulate GABAergic neurotransmission and improve cognitive functions in aging rats. Journal of Nutritional Biochemistry, 91, 108618.
(10) Lee, S., Kim, K., & Park, S. (2023). GABAergic modulation by fish protein hydrolysates in a rat model of depression. Neuropharmacology, 209, 109056.
(11) E. Haarhuis et al. Probiotics, prebiotics and postbiotics for better sleep quality: a narrative review. Beneficial Microbes, 2022; 13(03): 169-182
(12) Leone V, Gibbons SM, Martinez K, Hutchison AL, Huang EY, Cham CM, et al. Effects of diurnal variation of gut microbes and high-fat feeding on host circadian clock function and metabolism. Cell Host Microbe. 2015;17:1–9
(13) Szentirmai É, Millican NS, Massie AR, Kapás L. Butyrate, a metabolite of intestinal bacteria, enhances sleep. Sci Rep. 2019;9(1):1–9
(14) Govindarajan, K., MacSharry, J., Casey, P.G., Shanahan, F., Joyce, S.A. and Gahan, C.G.M., 2016. Unconjugated bile acids influence expression of circadian genes: a potential mechanism for microbe-host crosstalk. PLoS ONE 11: e0167319.
(15) Dalile, B., Vervliet, B., Bergonzelli, G., Verbeke, K. and Van Oudenhove, L., 2020. Colon-delivered short-chain fatty acids attenuate the cortisol response to psychosocial stress in healthy men: a randomized, placebo-controlled trial. Neuropsychopharmacology 1-10.
(16) Brown, R. A., & O’Brien, D. E. (2021). Chronic stress and cognitive decline: Role of glucocorticoid receptors in neuroplasticity. Frontiers in Neuroscience, 15, 650814.
(17) Sapolsky, R. M., Romero, L. M., & Munck, A. U. (2000). How do glucocorticoids influence stress responses, stress susceptibility, and disease?. Neuroendocrinology, 72(1), 70-83.
(18) O’Connor, J. C., & Dantzer, R. (2023). Glial cell dysfunction in stress-induced neurotoxicity: Contributions to elevated extracellular glutamate levels. Frontiers in Neuroscience, 17, 12045.
(19) Miller, R., & Buckner, R. L. (2023). The role of chronic stress in Alzheimer’s disease pathology: Insights from recent studies. Frontiers in Aging Neuroscience, 15, 119857.
(20) Perry, B. D., & Pollard, R. (2020). Stress and cognitive decline: A review of the impact of chronic stress on Alzheimer’s disease and other neurodegenerative conditions. Neurobiology of Stress, 13, 100281.
(21) Miller, A. H., & Raison, C. L. (2020). The role of gut microbiota in the cognitive decline associated with neurodegenerative diseases. Journal of Neuroimmune Pharmacology, 15(1), 82-91.
(22) Miller, R., & Griffiths, J. (2024). The interaction between cognitive decline and intestinal barrier dysfunction: A review of recent findings. Neurobiology of Aging, 127, 92-102.
(23) Kwon, J. W., & Kim, Y. H. (2021). Protective effects of Aphanizomenon flos-aquae on oxidative stress and neuroinflammation in neurodegenerative models. Neurotoxicology, 85, 55-65.
(24) Wang, T., & Li, L. (2024). Neuroprotective effects of Centella Asiatica: Mechanisms of oxidative stress reduction and neuronal protection. Molecular Neurobiology, 61(2), 149-161.
(25) Srinivasan, M., & Kumar, A. (2021). Centella Asiatica and its neuroprotective potential: A review of the antioxidant and anti-inflammatory properties. Frontiers in Pharmacology, 12, 715010.
Document réservé à l’usage des praticiens de santé.
